龙8long8,干细胞研究突破!开启国民健康新时代
国家发展改革委5月10日发布《“十四五”生物经济发展规划》,这是我国首部生物经济的五年规划,明确了生物经济发展的具体任务。
其实早在2021年6月,中国首款免疫细胞药物的上市已经标志着我国细胞治疗的时代正式开启。随机一年来国家及地方相继发布的多项支持政策,也表明了细胞医学行业的高速发展。


为进一步规范和指导干细胞产品的药学研发和申报,促进干细胞产业发展,2021年8月17日,国家药品监督管理局药品评审中心发布《人源性干细胞产品药学研究与评价技术指导原则(征求意见稿)》。
国家多个相关部委陆续颁布一系列扶持政策“细胞治疗及临床转化”成为我国“十四五”健康保障发展的重大课题。
可能光这样说,并不能看出我国是如此重视干细胞研究,那我们接下来回顾一下往年来支持细胞疗法的政策及声音。
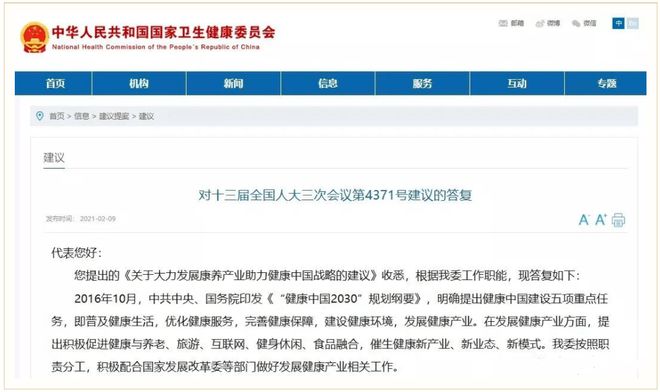
国家卫生健康委在官网上发布了《对十三届全国三次会议第4371号建议的答复》。答复函中明确提出:我委一直鼓励和支持干细胞、免疫细胞等研究、转化和产业发展。

为指导我国免疫细胞治疗产品研发,提供可参考的技术标准,在国家药品监督管理局的部署下,药审中心组织制定了《免疫细胞治疗产品临床试验技术指导原则(试行)》。

国家科技部发布《2021年“干细胞研究与器官修复”国家重点研发专项申报指南》。为落实“十四五”期间国家科技创新有关部署安排,国家重点研发计划启动实施“干细胞研究与器官修复”重点专项。2021年度指南围绕干细胞命运调控、基于干细胞的发育和衰老研究、人和哺乳类器官组织原位再生、复杂器官制造与功能重塑、疾病的干细胞、类器官与人源化动物模型等5个重点任务进行部署,拟支持17个项目,拟安排国拨经费概算4.4亿元龙8long8。


嵌合抗原受体T细胞治疗产品具有新颖性、复杂性和技术特异性的特点,随着此类产品的研发进展和陆续申报上市,为促进企业及早发现此类产品的风险,提供有效的风险最小措施,确保上市后安全性风险可控,有必要对申报上市的临床风险管理计划提出要求和提供指导。国家药审中心在充分调研的基础上起草了《嵌合抗原受体T细胞(CAR-T)产品申报上市临床风险管理计划技术指导原则(征求意见稿)》。

2022年1月4日,为贯彻实施《中华人民共和国药品管理法》,国家药监局组织起草了《药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》,面向社会公开征求意见。附录所述的细胞治疗产品是指人源的活细胞产品,包括经过或未经过基因修饰的细胞,如自体或异体的免疫细胞、干细胞、组织细胞或细胞系等产品,不包括输血用的血液成分、已有规定的移植用造血干细胞、生殖相关细胞,以及由细胞组成的组织、器官类产品等。

2022年2月8日,国家科技部发布关于对国家重点研发计划“干细胞研究与器官修复””等5个重点专项 2022 年度项目申报指南征求意见的通知。主要任务和涵盖热点:指南围绕“干细胞命运调控及机理”、“干细胞与器官的发生与衰老”、“器官的原位再生与机理”、“复杂器官制造与功能重塑”和“基于干细胞的疾病模型”等五大任务。涵盖热点包括:类器官、器官芯片,外囊泡(外泌体)、干细胞与器官抗衰老、器官原位再生、干细胞和生物材料。
去年的厦门细胞(生物)治疗临床研究研讨会上,钟南山院士也表示指出国务院《“十三五”国家战略性新兴产业发展规划》中:将干细胞与再生医学、肿瘤免疫细胞治疗、龙8long8手机登录CAR-T细胞治疗等新型诊疗服务列为发展的重点任务。

中国疾病细胞/生物治疗大会上,中国科学院院士王福生介绍了免疫细胞和干细胞在肝炎和新冠肺炎中的疗效。他指出:细胞作为一种药物是近十年的发展成果,这项新技术具有引领性、突破性、颠覆性,临床治疗更及时、更准确、更智能,使重大疾病的治疗有了更多、更好的选择。

第十九届中国西部海外高新科技人才洽谈会上,苏国辉院士也表示:干细胞治疗已经受到国家高度重视,我国对干细胞方面的政策也非常好,可以说我国干细胞行业正在良好的发展中。

中国干细胞第十一届年广州会上,中国科学院院士季维智也明确指出:中国在干细胞领域的研究,毋庸置疑位于世界第一梯队。我国内,包括地区,现已申报、注册的干细胞研究项目,已超过860个,多个方向齐头并进,呈现出勃勃生机。
近年来,我国大力支持干细胞研究。科技部每年投入大量资金推动干细胞研究与转化,干细胞治疗、免疫细胞治疗等新技术的突破也不负众望,让我们开启了国民健康的新时代!

以免疫细胞和干细胞为代表的细胞疗法一举成为开辟国民健康的新突破口,因其高度精准化和多潜能的优势,在越来越多种疾病的临床应用中显示出强力有效的作用——END