龙8头号玩家细胞治疗价格一览表细胞研究细胞凋亡的经典途径内质网应激6张图拿下5分
龙8国际头号玩家内质网(ER)应激作为癌症的新兴标志特征,对细胞增殖、转移、侵袭和化疗抵抗具有重要影响。卵巢癌(OvCa)是全球癌症相关死亡的主要原因之一,因为该病在诊断时通常已处于晚期。近年来,研究探讨了ER应激对OvCa的影响,但ER应激相关基因在OvCa预后中的预测作用尚未被探索。
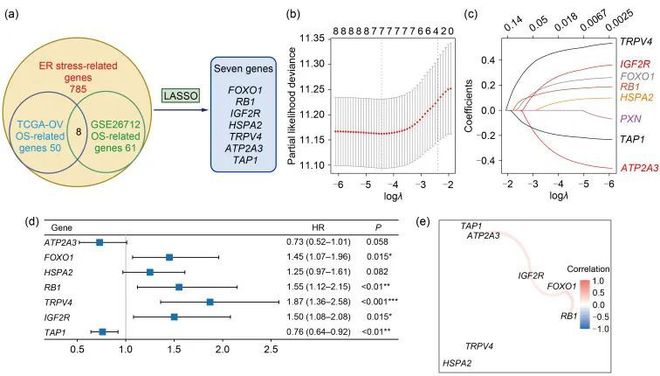
作者通过单变量Cox回归分析从癌症基因组图谱(TCGA)-卵巢癌(OV)队列(n=368)和基因表达杂志(GEO)数据集(访问号:GSE26712;n=184)中确定了与预后相关的基因。基因数量显示在工作流程图中(图1a)。经过交集运算,筛选出了8个可能与预后相关的基因(P0.05),分别是:瞬时受体电位阳离子通道亚家族Ⅴ成员4(TRPV4)、胰岛素样生长因子2受体(IGF2R)、Forkhead box O1(FOXO1;在GSE49997数据集中缺失)、视网膜母细胞瘤1(RB1)基因、热休克蛋白(HSP)家族A(HSP70)成员2(HSPA2)、鸟嘌呤(PXN)、转运蛋白1三磷酸腺苷(ATP)结合盒亚家族B成员(TAP1)和ATP酶肌浆/内质网Ca 2+ 转运3(ATP2A3)。然后,作者进行了最小绝对收缩和选择算子(LASSO)回归分析,从这8个内质网应激相关基因中选择出最可靠的预后基因。最终,根据最小标准决定的最佳λ值,保留了其中7个基因及其系数(图C中)。在这些基因中,ATP2A3和TAP1是卵巢癌存活的保护因子,风险比(HR)小于1;而FOXO1、HSPA2、RB1、TRPV4和IGF2R是风险因子,风险比大于1(图1d)。基于这七个基因的表达谱构建了一个相关网络,以确定它们之间的关系(图1e)。
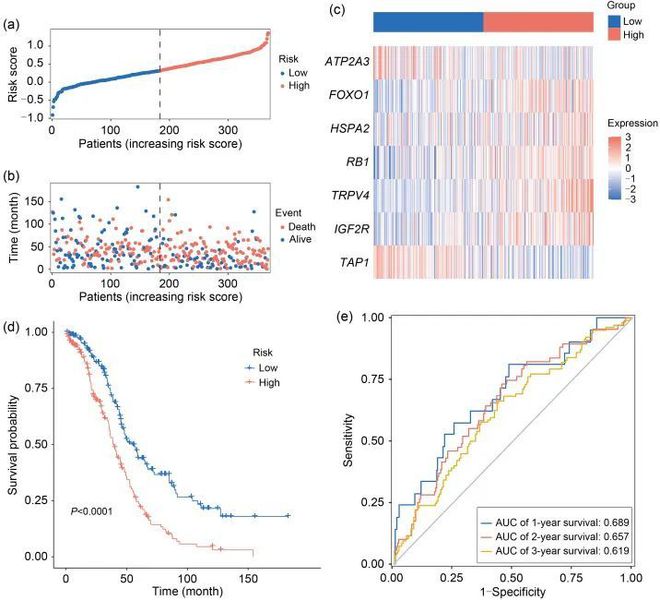
鉴于样本数量充足的特权,TCGA-OV队列被指定用于构建风险基因特征。根据中位数风险评分,184名患者被归类为低风险组,而其余184名患者被归类为高风险组(图2a)。进行了主成分分析(PCA)和t-分布随机邻域嵌入(t-SNE)分析,以将这些簇中的患者分配到相应的组别中。患者的整体生存(OS)相关预测模型分布如图2b所示,表明高风险组的患者死亡可能性更高,生存时间更短。两组之间每个内质网应激相关标志物的表达水平明显不同(图2c)。Kaplan-Meier(K-M)曲线显示低风险组的患者具有比高风险组更有利的生存结果(P0.0001;图2d)。进行了时间相关的受试者工作特征曲线(ROC曲线)分析,评估内质网应激相关风险标志对生存期的预测作用。如图2e所示,曲线下面积(AUC)在一年内为0.689,在两年内为0.657,在三年内为0.619。七个单基因的K-M曲线进一步验证了该标志在TCGA-OV队列中的预测价值。
随后,对TCGA-OV训练队列进行了单变量和多变量Cox分析,以探索风险评分是否可以作为独立的风险因素。如图3a、3b所示。ER应激相关的风险标记与OvCa患者的OS显著相关(HR,2.99;95%置信区间(CI),2.08-4.29;P0.001;参见多元Cox分析),表明TCGA-OV队列构建的ER应激相关风险标记是OvCa患者的独立预后因子。多指标ROC曲线c)显示了风险标记和临床特征的预测价值,表明ER应激相关风险模型在年龄、分级和分期方面的预测准确性优于其他因素。
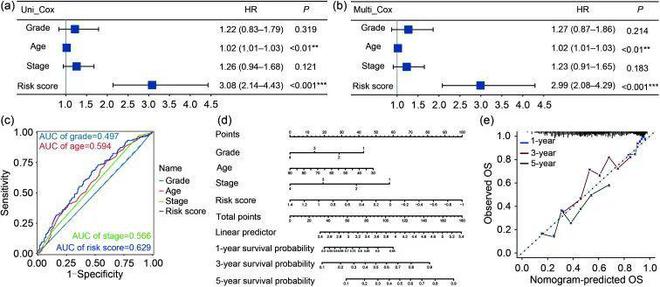
此外龙8头号玩家,作者制作了一个综合考虑内质网应激风险标志、分级、年龄和阶段的图表,用于预测TCGA-OV队列中1年、3年和5年的生存率(图3d)。在这个图表中,每个项目根据其对生存率的风险贡献被分配了相应的分数。校准曲线用于对图表进行内部验证(图3e)。总的来说,这些数据表明,内质网应激相关的风险标志可以作为TCGA-OV队列中的独立风险因素。
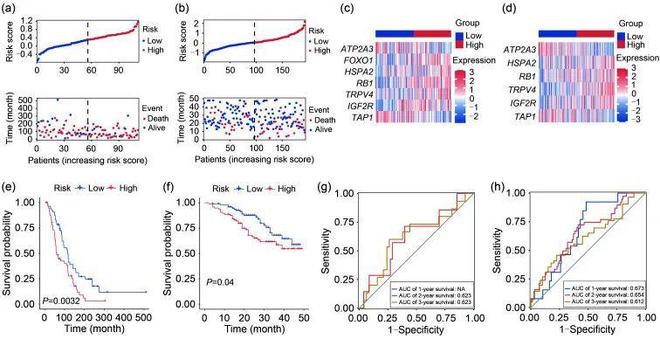
ICGC和GEO数据集(存取编号:GSE49997)共有117个案例被视为外部验证集。从表达谱阵列中提取了七个或六个(GSE49997中缺少FOXO1)与生存相关的基因。使用与TCGA-OV队列相同的公式计算了两个验证集中每个样本的风险评分。利用PCA和t-SNE分析,根据风险基因集可视化不同人群之间的风险分布。
图4a和4b分别显示了ICGC和GEO数据集中人群的OS相关风险模型分布。代表与ER应激相关的每个风险特征的表达水平的热图显示了验证集中低风险和高风险人群之间的变化趋势(图4c和4d)。有趣的是,作者进一步发现,在两个验证集中,高风险组的生存可能性都显著低于低风险组(ICGC队列中P=0.0032,GSE49997队列中P=0.04;图4e和4f)。然后,绘制与时间相关的ROC曲线,以评估验证集中ER应激相关风险特征的预测价值。如图所示。图4g和4h 在ICGC队列中,2年和3年的AUC分别为0.623和0.673,在GSE49997队列中,1年、两年和3年分别为0.654和0.612,这表明作者的模型在验证队列中具有强大的预测作用。再次应用单变量和多变量Cox分析的森林图,以确定作者的风险模型的独立预后作用。还构建了ER应激风险特征和可获得的临床参数整合的诺模图,以预测两个验证队列中的OS。校准曲线用于列线图的内部验证。在两个外部队列中测试的上述数据证明了该风险模型的稳健性。
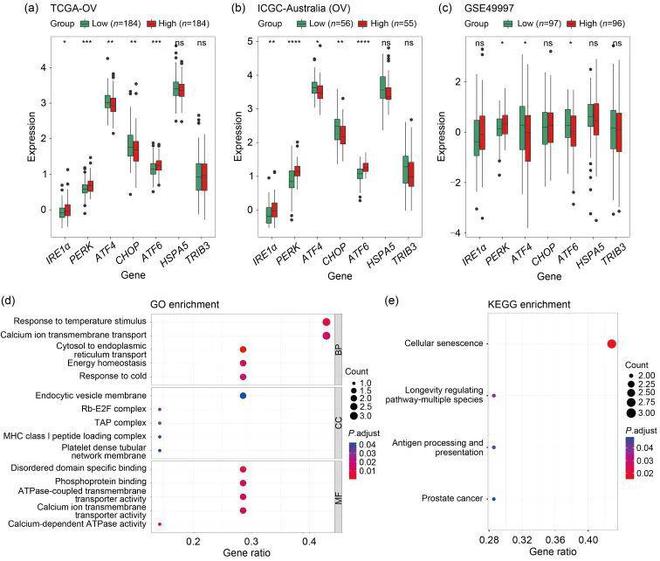
之前已经确定了三条经典的内质网应激途径,可能通过不同的方向决定细胞命运。通过分析作者的风险标志与这些经典内质网应激途径的中心基因之间的相关性,以确定不同卵巢癌组中的内质网应激状态。在高风险组中,IRE1α和PERK的水平高于低风险组,尽管在GSE49997数据集中的统计显著性较小。有趣的是,低风险组中的促凋亡途径(ATF4和CHOP)上调,证明了作者标志的与细胞命运相关的作用(图5a-5c)。为了评估这些与预后相关的基因的功能,进行了基因本体论(GO)和京都基因与基因组百科全书(KEGG)途径分析。GO的前五个富集术语如图5d所示,KEGG的前四个富集术语如图5e所示。进一步采用基因集富集分析(GSEA)方法来补充这些基因的功能注释。结果表明,这些基因在多个细胞因子相互作用和免疫相关术语中富集。
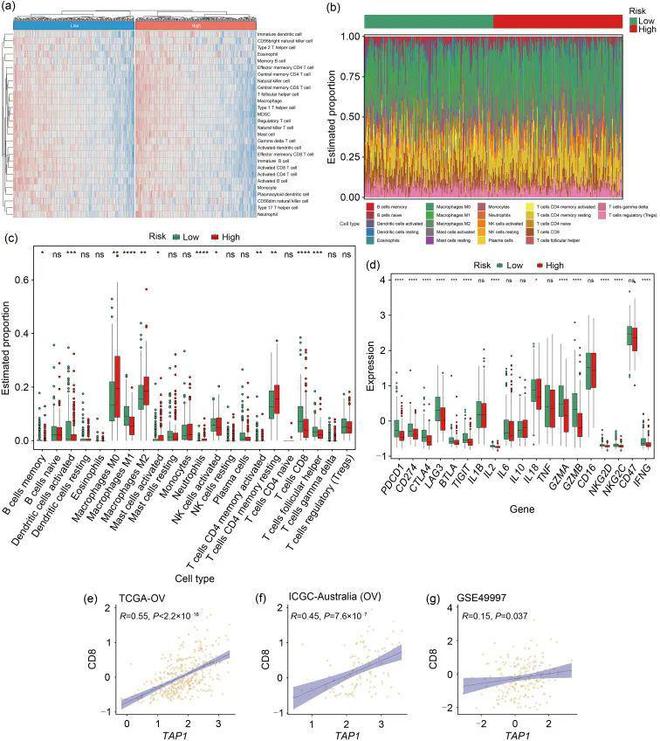
TAP1的表达水平与CD8呈正相关,这可能意味着抗肿瘤成分的浸润状态。总之,这些结果支持了ER应激相关风险特征可能通过与OvCa中的免疫微环境相互作用来影响疾病进展的假设。
总之,作者的工作确定了ER应激相关的风险特征,为OvCa预后预测提供了新的注释。双重验证证明了该标志的稳健性。此外,已证实经典ER应激途径的优先臂参与了低风险和高风险人群。对OvCa中ER应激相关基因的富集和免疫浸润谱的分析为未来研究其与抗肿瘤免疫之间的机制提供了重要的发现。