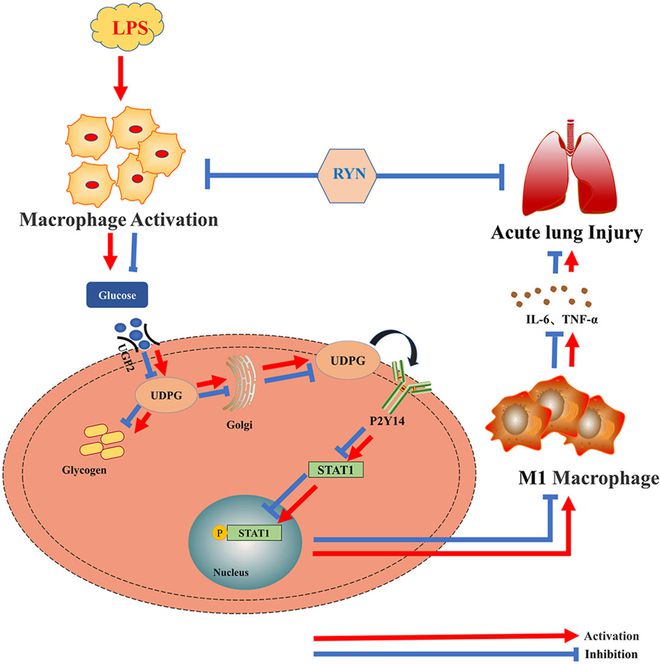
龙8long8,民族药理-陕西中医药: 热炎宁合剂通过糖原合成途径抑制M1巨噬细
热炎宁合剂(RYN)是由蒲公英、虎杖、北败酱、半枝莲等组成的中药,用于治疗急性呼吸系统疾病,具有显著的临床疗效。急性肺损伤(ALI)是一种以急性呼吸衰竭为特征的临床常见疾病。本研究旨在评价RYN对ALI的治疗作用,并探讨其作用机制。采用超高效液相色谱-串联质谱法(UPLC-MS/MS)对RYN的化学成分进行了分析; 以7.5 mg/kg LPS诱导大鼠ALI,RYN通过灌胃给药,观察包括肺组织形态学、肺湿/干(W/D)重量比、肺通透性指数(LPI)、HE染色、Wright-Giemsa染色。ELISA法检测血清TNF-α、IL-6、IL-10、1型精氨酸酶(Arg-1)、尿苷二磷酸葡萄糖(UDPG)水平。免疫组化染色、免疫荧光、免疫印迹、定量逆转录聚合酶链反应(qRT-PCR)结合采用多种组学技术预测RYN的潜在作用机制,并通过体内封闭实验进行了验证。RYN被检测出含有1366种代谢产物,其中一些高水平的代谢产物具有抗炎、抗菌、抗病毒和抗氧化特性。RYN通过减少炎症细胞浸润和氧化应激损伤、抑制CD86表达、降低TNF-α和IL-6水平以及增加IL-10和Arg-1水平,对ALI大鼠产生剂量依赖性治疗作用。转录组学和蛋白质组学表明,葡萄糖代谢为RYN的抗ALI特性提供了途径,并且RYN抑制肺糖原的产生和分布。免疫荧光共染色显示RYN抑制CD86和UGP2的表达。体内阻断实验显示,阻断糖原合成可降低UDPG含量,抑制P2Y14和CD86的表达,降低P2Y14、STAT1 mRNA和蛋白的表达,减少STAT1蛋白磷酸化的表达,具有与RYN相同的治疗效果。因此,RYN抑制M1巨噬细胞极化以减轻ALI。阻断糖原合成和抑制UDPG/P2Y14/STAT1信号通路可能是其分子机制。
通过UPLC-MS/MS在RYN中总共检测到1366种代谢物(图1A和B)。其中,九种化合物,如木犀草素-7-O-葡萄糖醛酸,在RYN中具有相对较高的水平(图1C–K)。木犀草素-7-O-葡糖苷酸和野黄芩素-7-O-葡萄糖苷酸参与细胞凋亡、组织修复、细胞外基质降解和炎症反应;腺苷、咖啡酸、异绿原酸A和异绿原酸C具有强烈的抗炎、抗菌和抗病毒特性,通常应用于与氧化应激、炎症反应和病毒感染相关的疾病;山奈酚-3-O-葡萄糖醛酸和N-阿魏酰酪胺对LPS刺激的细胞和小鼠模型具有抗炎作用;木犀草素-7-O-新橘皮糖苷可预防ALI的炎症反应和细胞凋亡。因此,RYN中所含的化合物具有抗炎、抗病毒和抗氧化特性,有助于预防和治疗ALI。
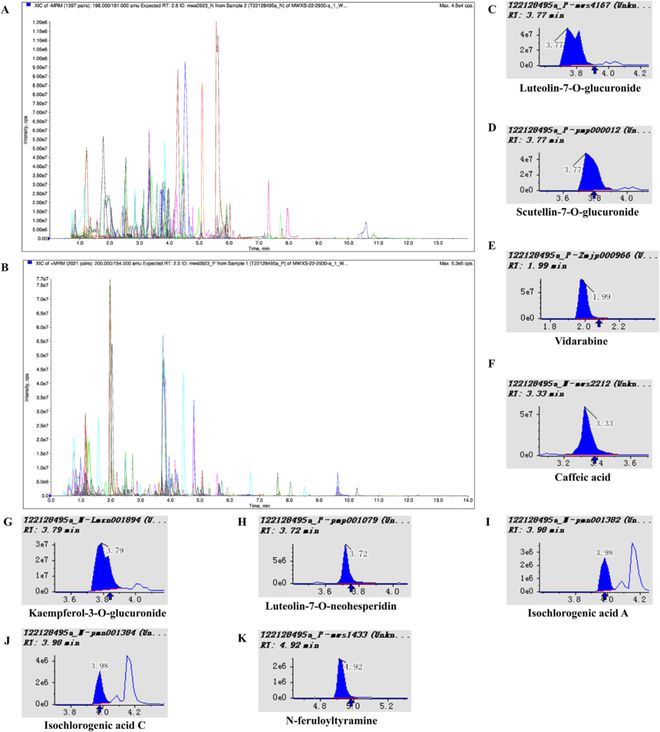
图1 采用UPLC-MS/MS对RYN的化学成分进行了分析。(A–B)代谢物检测的多模式图(A表示负离子模式,B表示正离子模式,水平坐标为代谢物检测的保留时间(Rt);纵坐标是离子检测的离子电流强度(cps,每秒计数),每个色谱峰代表一种代谢物,峰面积代表相对含量)。(C–K)不同样品中含量相对较高的9种化合物的定量分析和积分校正结果。水平坐标为代谢物检测的保留时间(min),垂直坐标为离子电流强度(cps),峰面积表示该物质在样品中的相对含量。
为了评估RYN的治疗效果,我们建立了ALI大鼠模型,并给予RYN和地塞米松(Dex)(图2A)。结果表明:与正常(Con)组相比,LPS组大鼠在LPS诱导2小时内出现低热 ,并且从2 h到12 h具有发烧趋势(图2B);肺容量增加,质地变硬,肺充血和炎性渗出增多(图2C);W/D比和LPI显著增加,表明存在肺水肿(图2D和E);H&E染色显示肺泡腔缩小消失,肺泡间隔增厚,并出现明显的炎症细胞浸润(图2F和G)。与LPS组相比,RYN对大鼠肺损伤的改善呈剂量依赖性,RYNH和Dex具有相似的疗效。
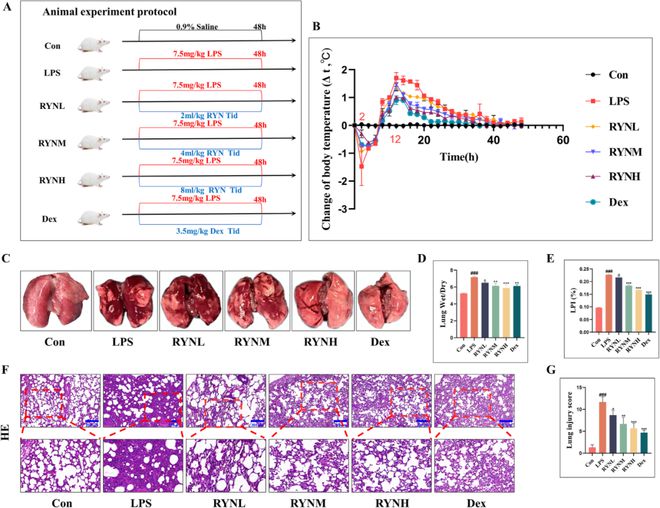
图2 RYN对LPS诱导的ALI大鼠有一定的治疗作用。(A)LPS诱导的大鼠ALI模型(n = 每组10个)。(B)大鼠温度的动态监测(n = 每组10个)。(C)各组大鼠大体肺形态。(D)肺组织湿/干重比(W/D)(n = 每组5个)。(E)肺渗透指数(LPI)(n = 每组10个)。(F) H&E染色的组织病理学变化(100倍和200倍显微镜)。(G)肺损伤的病理评分,包括肺水肿、出血、肺泡壁增厚、肺泡结构破坏、白细胞浸润和间质增生。使用4分制(0表示正常;1表示轻微;2表示中等;3表示严重)来计算总肺损伤。所有数据均表示为平均值 ± 标准偏差。与Con组比较,###P<0.001;与LPS组相比,*P0.05、**P0.01和***P 0.001。
肺部炎症细胞的激活释放出大量炎症因子,形成“炎症因子风暴”,这是ALI/ARDS的重要原因。通过Wright Gimsa染色,我们发现与Con染色相比,LPS染色显著增加了肺白细胞的数量,中性粒细胞是最显著的染色。RYN和Dex处理降低了白细胞的增殖,RYNH和Dex的治疗效果相似。通过检测所研究的肺组织中炎症细胞和促炎细胞因子IL-6的表达,我们发现LPS组大鼠肺组织中的中性粒细胞、巨噬细胞和IL-6与Con组相比显著增加;RYN起抑制作用;RYNH和Dex的抑制作用显著(图3A–F)。炎症细胞的过度激活会导致各种有害物质的分泌,导致氧化应激损伤。通过检测大鼠体内氧化产物和还原产物的含量(图3G–K),我们的发现表明,LPS组的氧化产物(ROS和MDA)含量显著高于Con组,而抗氧化产物(SOD、NADPH/NADP+、GSH/GSSG)水平显著降低。RYN有效地逆转了这两种现象,减少了氧化应激损伤龙8long8,而RYNH更具优势。
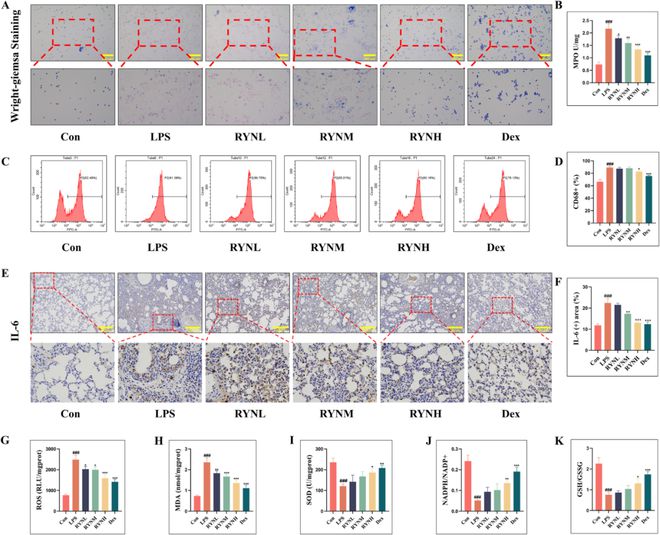
图3 RYN可以治疗ALI相关的肺组织炎症浸润和氧化应激。(A)用Wright giemsa染色法观察中性粒细胞染色。(B)MPO生化测试,反映中性粒细胞含量(每组n=3)。(C–D)流式细胞术用于检测CD68抗体,反映肺巨噬细胞的含量(每组n=3)。(E–F)通过免疫组织化学染色检测IL-6,并量化阳性区域。(每组n=3)(G–K)进行MPO、SOD、ROS、MDA、NADPH/NAPH+、GSH/GSSG的生化测试,以评估大鼠的氧化应激损伤。所有数据均表示为平均值±标准差(每组n=3)。与Con组比较,###P<0.001;与LPS组相比,*P0.05、**P0.01和***P 0.001。
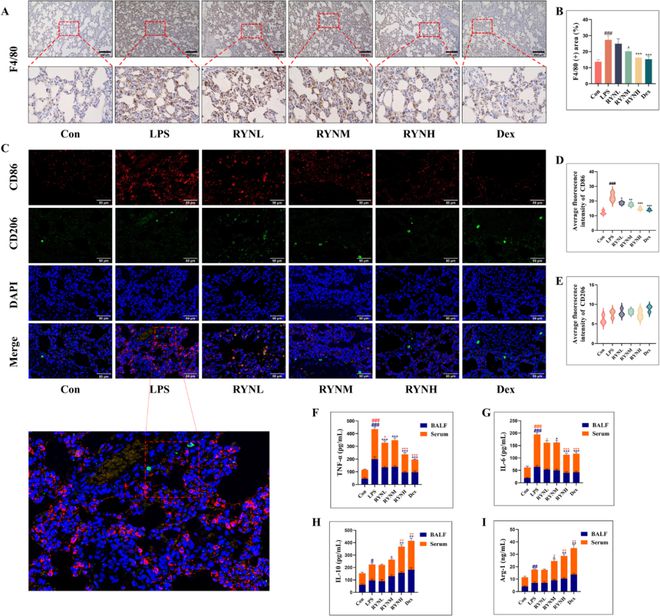
巨噬细胞极化平衡在产生炎症反应中起着重要作用。在本研究中,使用免疫组织化学和免疫荧光共染色来检测巨噬细胞表面标记物F4/80和M1/M2极化标记物CD86和CD206的表达(图4A–E)。我们还检测了大鼠肺泡灌洗液(BALF)和血清中TNF-α、IL-6、IL-10和Arg-1细胞因子的表达(图4F–I)。结果显示,与Con组相比,LPS组大鼠肺组织中F4/80的表达显著增加,表明LPS刺激导致巨噬细胞处于高度活化状态,而在RYN和Dex组中F4/80的表达受到抑制。同时,我们发现CD86的表达在LPS组中显著增加,在RYN处理组和Dex组中均显著降低,并且RYN以剂量依赖的方式抑制CD86的表现。CD206的表达在任何一组中都没有显著差异。ELISA结果显示TNF-α和IL-6在LPS组大鼠血清和BALF中的表达水平显著升高,而RYN有效抑制了这些促炎因子的表达,并且RYNH组和Dex组显示出几乎相同的治疗效果。此外,我们还发现,IL-10在LPS组中呈增加趋势,在RYNM、RYNH和Dex组的BALF呈增加趋势,而在RYNH、Dex组的血清呈增加趋势。在LPS组、RYNM、RYNH和Dex组的BALF以及RYNM、RYNH和Dex组的血清中,Arg-1呈增加趋势。这些结果表明,RYN以剂量依赖的方式抑制巨噬细胞活化,减少M1型极化,减少TNF-α和IL-6,增加IL-10和Arg-1,并抑制炎症。
为了研究RYN的调控机制,我们对Con、LPS和RYNH组进行了转录组学和蛋白质组学研究。结果显示,13008个基因在RYNH组和LPS组中均表达(图5A)。聚类分析的结果表明,差异表达的炎症基因被RYN下调(图5B),证实了RYN在减轻ALI炎症损伤方面的有效性。样本关系分析显示,三组样本的空间分布不重叠,表明它们具有良好的关系和可比性(图5C)。在将阈值倍数变化调整为1.2后,发现与LPS组相比,RYNH组中1373个蛋白质上调,434个蛋白质下调(图5D)。在对两个组学进行关联分析后,我们确定了差异基因和差异蛋白之间的317个交叉点(图5E)。关联通路分析显示,“代谢通路”的关联性最强,表明RYN可能通过代谢通路对ALI发挥其治疗作用(图5F)。此外,京都基因和基因组百科全书(KEGG)对“代谢途径”差异的分析显示,“碳水化合物代谢”最为丰富(图5G)。先前的研究表明,葡萄糖代谢作为一种碳水化合物代谢,在调节炎症损伤(包括自身免疫性疾病和感染)方面发挥着至关重要的作用。因此,我们检查了糖原在大鼠肺组织中的分布,并量化了糖原含量(图5H和I)。与Con组相比,LPS组大鼠肺组织中糖原分布范围更宽,含量显著更高,RYNH处理表现出抑制作用,这与组学预测的结果一致。因此,我们得出结论,RYN的抗ALI作用与糖原合成途径有关。
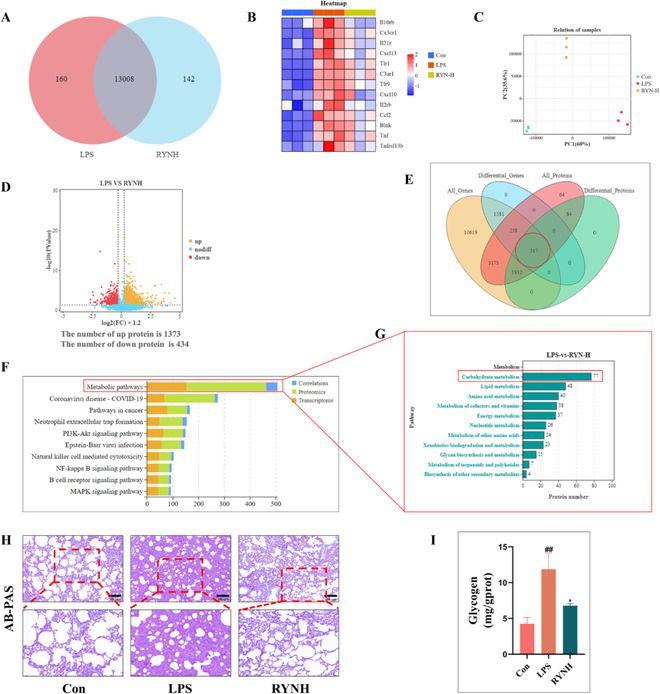
图5 多种组学的联合分析表明,RYN通过糖原合成途径抑制炎症来治疗ALI。(A)转录组样本基因关系。(B)转录组1.2倍差异炎症基因热图(n = 每组3个)。(C)蛋白质组样品的空间分布。(D)1.2倍的蛋白质组学差异蛋白火山图显示,RYNH处理使1373个蛋白质上调,龙8hk登录434个蛋白质下调。(E)转录组学关联分析与蛋白质组学的基本示意图。(F)组学关联分析发现代谢途径的相关性最强。(G)代谢途径差异KEGG分析显示碳水化合物代谢最为丰富。(H)通过AB-PAS染色观察糖原在肺组织中的分布(糖原为红色)。(I)糖原含量的定量分析,以验证糖原合成与ALI之间的关系。所有数据均表示为平均值 ± 标准偏差(n = 每组3个)。与Con组比较##P<0.01。与LPS组比较*P 0.05。
上述发现表明,RYN抑制M1巨噬细胞极化,从而发挥抗ALI炎症作用,并且这种作用与糖原合成有关。为了进一步研究RYN的作用机制,我们首先共标记了UGP2(UDP葡萄糖焦磷酸化酶2),糖原合成的关键酶,通过与CD86一起免疫荧光共染色探讨糖原合成与M1巨噬细胞极化之间的关系(图6A–C);然后,我们通过PCR和ELISA检测UGP2 mRNA表达和糖原合成的关键化合物UDPG(UDP葡萄糖)含量水平(图6D和E)。结果显示,与Con组相比,LPS组大鼠肺组织中UGP2表达、CD86表达、UGP2 mRNA水平和UDPG水平显著升高。与LPS组相比,RYN组的UGP2表达龙8long8、CD86表达、UGP2 mRNA表达和UDPG含量呈剂量梯度下降。RYNH的疗效与Dex相似。因此,我们认为ALI大鼠肺中巨噬细胞的糖原合成过程增强,从而增加肺中糖原的积累,促进M1巨噬细胞极化,并加剧炎症反应。发现RYN对该过程具有抑制作用。
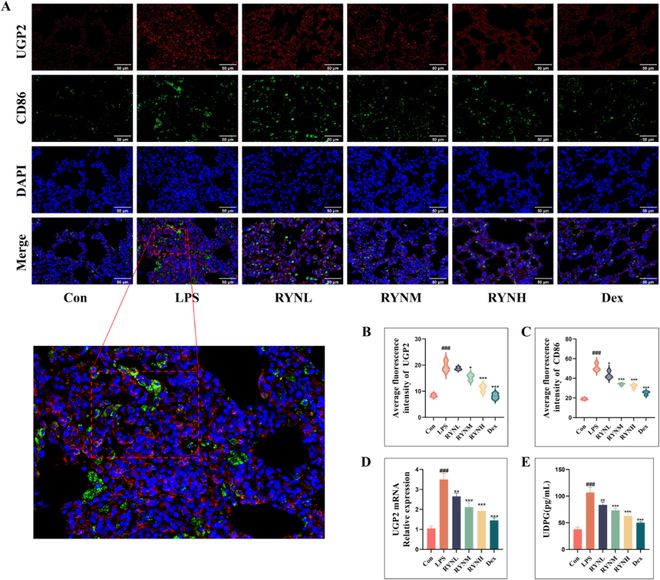
图6 RYN通过抑制糖原合成来减少巨噬细胞的M1极化。(A–C)免疫荧光共染色用于标记UGP2和CD86,以探索糖原合成和巨噬细胞M1极化之间的关系(n = 每组3个)。(D)用聚合酶链式反应检测UGP2 mRNA的表达(n = 每组3个)。(E)ELISA法检测UDPG含量(n = 每组3个)。所有数据均表示为平均值 ± 标准偏差。与Con组相比,#P 0.05和###P<0.001。*P0.05、**P0.01和***P 0.001与LPS组相比。
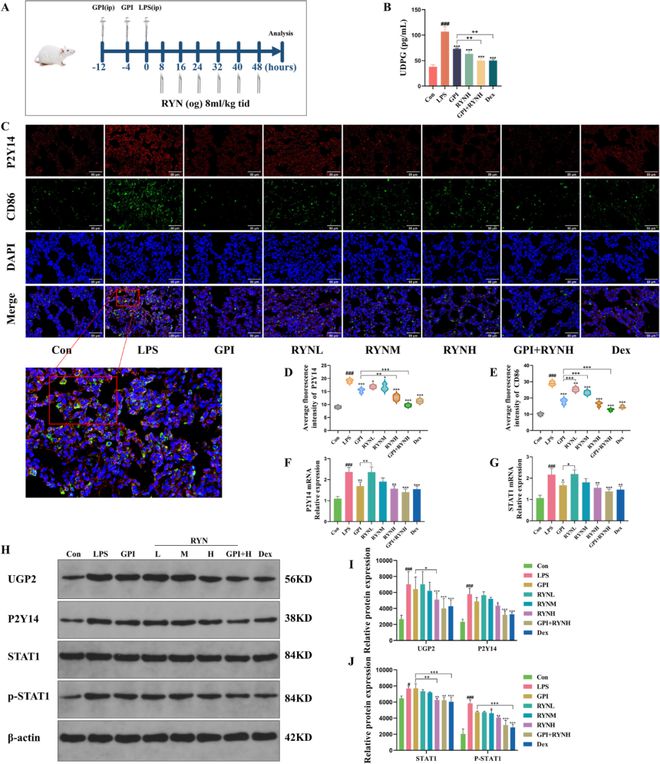
7.RYN通过抑制糖原合成干预UDPG/P2Y14/STAT1信号通路激活,从而抑制M1巨噬细胞极化
UDPG/P2Y14/STAT1信号通路来源于糖原合成通路,可激活巨噬细胞炎症极化,这一过程可能是RYN抗ALI作用的关键因素。为了验证这一点,我们使用糖原磷酸化酶(GPI)进行了体内阻断实验(图7A)。结果显示,与LPS组相比,使用GPI后UDPG含量显著降低,GPI与RYN联合处理具有与Dex相似的协同作用(图7B)。免疫荧光结果显示,与Con组相比,LPS组P2Y14和CD86的表达增加;单独用GPI、RYN或Dex处理抑制P2Y14和CD86的表达;GPI与RYN联合显示出更强的抑制作用(图7C–E)。PCR结果显示,与Con组相比,LPS组P2Y14和STAT1mRNA表达显著增加。与LPS组相比,单独使用GPI、RYN或Dex均可抑制P2Y14和STAT1 mRNA的表达,而GPI和RYN联合使用则产生更显著的效果。免疫印迹结果显示,LPS组的UGP2、P2Y14、STAT1和p-STAT1蛋白水平显著高于Con组。然而RYN和Dex比LPS组显著降低了这些蛋白质的表达,GPI和RYN的联合处理比单一给药方法更有利(图7F–J)。基于上述研究结果,我们得出结论,RYN与GPI联合作用相同,即通过阻断糖原合成抑制UDPG/P2Y14/STAT1信号通路的激活,从而抑制M1巨噬细胞极化,发挥抗炎和抗ALI作用。
在这项研究中,我们证明了 RYN可以预防ALI。 随后的研究表明, RYN可以显著降低M1巨噬细胞的极化,减轻肺部炎症。 多组学分析表明, RYN的抗ALI作用可能与糖原合成途径有关。 通过使用糖原磷酸化酶( GPI)和联合RYN,证实阻断糖原合成、下调UDPG/P2Y14/STAT1信号通路和抑制巨噬细胞活化是其抗ALI的分子机制。 本研究强调了阻断糖原合成途径在改善 ALI中的关键作用,并为临床上通过调节糖原合成来缓解肺部炎症性疾病提供了新的视角。
ALI是一种常见的急危性疾病,是全身炎症反应综合征肺损伤的急性表现。 由于其复杂的发病机制和特殊的致病因素,目前尚无针对 ALI的特效药。RYN合剂是一种中成药,已广泛应用于各种呼吸道疾病的临床治疗,并在我国防治新冠肺炎方面取得了良好的疗效,引起了我们的关注。LPS通常用于ALI的动物模型,并且通常与蛋白质介导的toll样受体4(TLR4)结合以诱导炎症反应。LPS诱导的ALI具有特征性好、相似性高的优点 。
在本研究中,腹腔注射 LPS导致大鼠体温升高,并导致大鼠肺部弥漫性肺泡损伤、肺水肿和炎症细胞浸润等病理变化,这与ALI症状高度一致。 相反,在大鼠模型中, RYN 处理 减轻了发烧症状,减少了肺水肿,并显著改善了肺病理损伤,更高的剂量更有利。中性粒细胞和巨噬细胞的激活是诱导免疫和炎症反应的标志,在ALI中起着重要作用。IL-6作为介导急性炎症反应的主要信号分子,可以作为“一线”炎症指标。 我们的研究表明, RYN抑制了ALI大鼠肺中中性粒细胞和巨噬细胞的活化,抑制了IL-6的表达,改善了肺炎症细胞的浸润,并减轻了肺中的氧化应激损伤。 总之,这些发现表明 RYN对ALI有显著的治疗作用。
巨噬细胞具有高可塑性和多功能性。它们可以根据微环境刺激和信号做出功能反应,并分化为 M1/M2表型,以调节体内的免疫和炎症反应。M1型具有高水平的标志物表达,如CD86,并分泌大量的炎性细胞因子,龙8hk登录如TNF-α和IL-6,在感染过程中参与病原体的清除并促进炎症。 相反, M2型释放抗炎因子,从而促进组织修复和血管生成。 研究表明,抑制 M1巨噬细胞极化可减轻炎症反应,改善ALI/ARDS的预后。 在本研究中,我们在 LPS诱导的ALI大鼠中观察到肺泡巨噬细胞(主要是M1巨噬细胞)总数的显著增加和M2巨噬细胞的不显著增加。TNF-α和IL-6水平显著升高,加剧了炎症损伤,但RYN对这些变化有抑制作用,并起到抗炎作用。RYN组分中的咖啡酸和N-feruloylethylamine已被发现能抑制巨噬细胞的炎症反应,这可能是其抑制M1巨噬细胞极化的关键。
转录组学涉及基于 RNA水平研究基因功能和特征,以确定生物过程和疾病的分子机制, 而蛋白质组学涉及分析蛋白质的数量、组成、结构和相互作用关系,从而补充转录组学。通过这两种组学方法,我们发现糖原代谢是 RYN抗ALI作用的关键。 糖原代谢在调节炎症巨噬细胞的功能方面也起着重要作用。在巨噬细胞的炎症激活过程中,葡萄糖摄取率增加,糖原积累在多种酶的作用下完成。其中, UDP葡萄糖(UDPG)是一种活性葡萄糖,被称为诱导先天免疫反应的 “红旗” 。 它在糖原合成途径中产生,并通过转运蛋白糖基化为高尔基体。然后以自分泌或旁分泌的方式进一步释放到细胞外空间,与其特异性配体 P2Y14受体结合,并引发一系列反应,导致STAT1的进一步激活和快速磷酸化进入细胞核,介导TNF-α、IL-1β、IL-6等炎性基因的表达,并驱动巨噬细胞M1极化 。
与我们的预测一致,我们的研究结果表明, LPS诱导的大鼠肺部积聚了大量糖原,这与ALI引起的高炎症水平密切相关,并且RYN可以通过干预糖原合成来抑制M1巨噬细胞的极化。GPI特别作用于糖原的合成和降解途径。 通过 GPI阻断实验,我们发现ALI大鼠的UDPG/P2Y14/STAT1信号通路被激活,促进M1巨噬细胞极化。 此外, RYN显示出与GPI相同的作用,抑制UDPG/P2Y14/STAT1信号通路。
这项研究仍有一些局限性。首先,在本研究中,我们主要在体内观察到 RYN可以通过抑制巨噬细胞M1极化来改善LPS诱导的急性肺损伤,这可能依赖于UDPG/P2Y14/STAT1通路的调节。 体内实验的结果是可靠的。然而,这项研究缺乏一些细胞实验来验证体内的结果。其次,本研究应用 UPLC-MS/MS分析了RYN混合物,并证明了其中最丰富的九种成分,其中咖啡酸、N-feruloylethylamine在相关研究中已被证明能够抑制巨噬细胞活化,但它们是否影响糖原合成途径仍需进一步深入评估。 我们将进一步探索 RYN中的活性成分,并继续探索糖原合成途径在巨噬细胞活化和炎症性肺部疾病中的中心作用。