龙8long8,Nature子刊:宋相容陶伟团队开发新型纳米药物靶向巨噬细胞治疗
以动脉斑块逐渐沉积为特征,最终可能导致动脉粥样硬化血栓等心血管事件,慢性未解决的炎症和活性氧(ROS)的过度生成,是动脉斑块进展的主要驱动因素。纳米治疗剂具有消除炎症和清除活性氧的作用,具有治疗动脉粥样硬化的潜力。
该研究使用靶向肽修饰的黑磷纳米片(BPNS),将Resolvin D1(一种炎症消退的脂质介质)靶向递送到病变的巨噬细胞,增强抗动脉粥样硬化的疗效龙8long8。该研究提出了一种动脉粥样硬化的治疗新策略,并强调了基于BPNS的疗法在治疗其他炎症性疾病方面的潜力。

最近一项临床试验显示,卡纳单抗(Canakinumab,一种可中和促炎IL-1β细胞因子的单克隆抗体)治疗显著减少了心血管事件。然而,它也增加了致死染,主要原因是该单抗会导致宿主防御功能受损。另一项临床试验显示,低剂量甲氨蝶呤(一种抗炎药物)的全身治疗未能减少促炎细胞因子的表达或心血管事件。这两项临床试验的治疗结果表明,有效地将治疗药物递送到动脉管壁的病变区域可以显著提高治疗效果并减少不良反应。
病变的巨噬细胞中活性氧(ROS)的过量产生是动脉粥样硬化进展的另一个关键因素,其通过增加氧化应激,导致细胞凋亡,以及激活炎症反应。此外,促炎巨噬细胞产生的局部炎症与ROS的过度产生相关。由于炎症是动脉粥样硬化形成过程中ROS过度生成的一个致病因素龙8long8,由于炎症是动脉粥样硬化形成过程中ROS过度生成的一个致病因素,龙8hk登录因此尽管具有挑战性,但解决炎症和抑制病变ROS生成以提高疗效的治疗策略对于动脉粥样硬化的治疗具有重要意义。尽管一些纳米药物临床前研究已经证明其具有双重治疗功能,但其在疾病部位的低蓄积、复杂的合成途径和潜在的毒性等问题可能阻碍其临床转化。
因此,我们迫切需要合成具有生物相容性的纳米材料,不仅具有抗氧化和抗炎功能,而且能够增强在疾病部位的蓄积。
二维的黑磷纳米片(BPNS)因其独特的理化性质和优越的生物相容性,在纳米医学领域得到了广泛研究。有临床前研究表明,龙8hk登录BPNS可有效清除过量的活性氧(ROS),从而减轻急性肾损伤。
基于这一模式,研究团队开发了生物相容的靶向性BPNS纳米治疗药物,不仅改善了病灶巨噬细胞的蓄积,而且还提高了清除活性氧(ROS)和缓解动脉粥样硬化斑块炎症的能力,弥补了之前的不足。
与传统的纳米载体递送药物的策略不同,该研究开发了一种创新的“纳米药物递送药物”方法来治疗动脉粥样硬化,展示了黑磷纳米片(BPNS)作为动脉粥样硬化治疗药物的潜力。
该研究表明,BPNS可有效清除广谱活性氧(ROS),并抑制病变巨噬细胞产生与动脉粥样硬化相关的促炎细胞因子。该研究还证明了基于ROS反应的靶向肽(S2P多肽)修饰的BPNS载体()可将Resolvin D1(RvD1,一种炎症消退介质)选择性递送到病变的巨噬细胞,从而进一步增强抗动脉粥样硬化的疗效。
这种靶向纳米药物(/R)不仅减少了高脂饮食喂养的载脂蛋白E缺陷(Apoe-/-)动脉粥样硬化小鼠模型的斑块面积,而且显著提高了斑块的稳定性,从而增强抗动脉粥样硬化疗效。
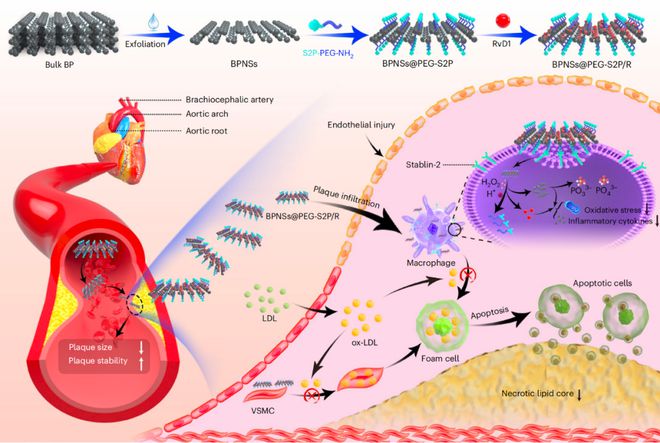
总的来说,这项研究提出了一种动脉粥样硬化的治疗新策略,并强调了基于黑磷纳米片(BPNS)的疗法在治疗其他炎症性疾病方面的潜力。