龙8long8,iMeta 慢性乙型肝炎肝内炎症的细胞特异性基因表达
和肝细胞癌而导致死亡。尽管抗病毒治疗,如核苷类似物和干扰素的联合使用,广泛应用于CHB患者,但这些治疗方法无法根除病毒,实现CHB的功能性治愈仍然是一个巨大的挑战。除此之外龙8long8,肝内炎症的形成机制尚不完全清楚,而
该研究旨在通过整合肝脏的整体转录组数据、单细胞测序数据和临床数据,从多组学角度分析导致CHB肝内炎症形成的因素。
研究团队开发了一个贝叶斯线性模型,将基因表达与临床参数联系起来,并更新了特定细胞类型的表达分析(PSEA),以在不同临床阶段将整体基因表达分解为特定细胞类型。这种多组学整合的方法可以帮助我们揭示CHB肝内炎症的细胞和分子机制,为未来的诊断和治疗提供新的见解(图1)。
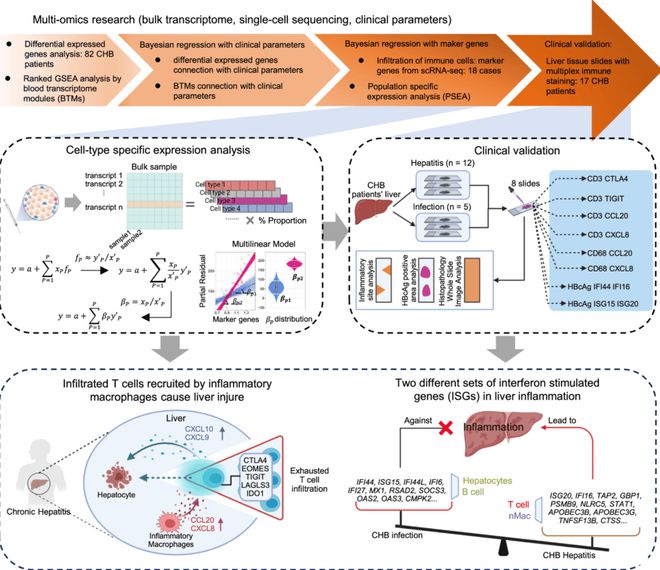
研究团队选取了82名CHB患者,根据HBeAg状态、HBV血清载量和血清ALT水平,将患者分为四个临床阶段:HBeAg阳性慢染、HBeAg阳性慢性肝炎、HBeAg阴性慢染和HBeAg阴性慢性肝炎。对肝活检样本进行的组织学检查排除了脂肪肝和其他肝病患者。
主成分分析(PCA)显示,CHB患者肝内基因表达谱在慢性肝炎阶段显著上调,特别是与免疫过程相关的基因富集。基因集富集分析(GSEA)揭示了多种已知的肝损伤途径,如细胞凋亡、焦亡、坏死和自噬性细胞死亡的上调。(见图2)
GSEA分析:显示多种与免疫和炎症相关的基因在慢性肝炎阶段上调,如细胞因子、趋化因子和干扰素刺激基因(ISGs)。
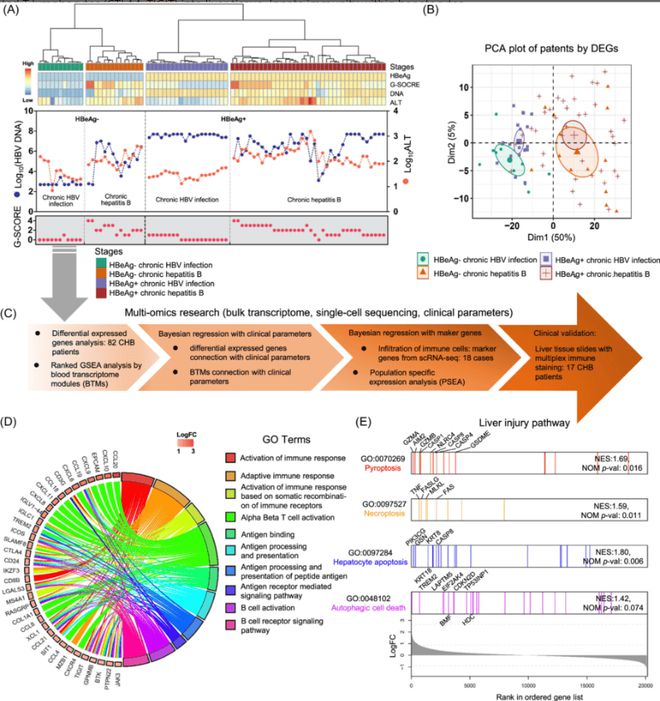
(该图展示了基于单细胞 RNA 测序数据的肝脏中细胞类型特异性标记基因,龙8登录揭示了与免疫过程相关的基因富集。图中还包括了与肝损伤相关的途径,如细胞凋亡、焦亡、坏死和自噬性细胞死亡的上调情况。)
研究合并并标准化了来自人类肝脏的三组10×基因组单细胞RNA测序数据,映射并可视化了13种细胞类型。通过UMAP方法,将这些细胞类型如肝细胞、胆管细胞、T细胞、B细胞和巨噬细胞等进行展示和分析。 (见图3)
通过UMAP方法分析了单细胞RNA测序数据,识别并可视化了肝脏中的13种细胞类型,包括肝细胞、胆管细胞、T细胞、B细胞和巨噬细胞。每种细胞类型都有特异性的标记基因,如肝细胞的ALB、胆管细胞的KRT19、T细胞的CD3D、B细胞的CD79A和巨噬细胞的CD68。
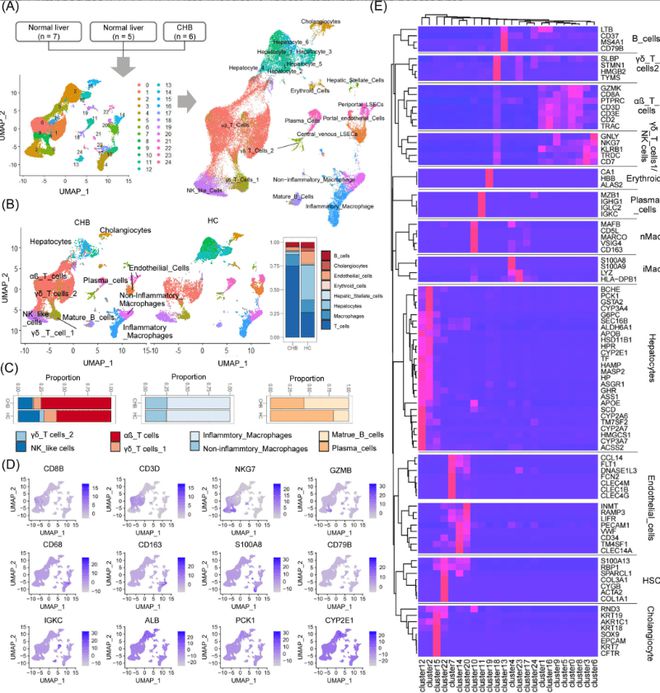
(该图展示了三组10×基因组单细胞RNA测序数据的UMAP分析结果,识别出13种肝脏细胞类型。每种细胞类型都通过特异性标记基因进行标识,如肝细胞的ALB、胆管细胞的KRT19、T细胞的CD3D、B细胞的CD79A和巨噬细胞的CD68。)
T细胞、NK细胞、成熟B细胞和巨噬细胞在肝炎阶段的肝样本中表达显著上调。血清ALT水平与大多数T细胞和巨噬细胞标记基因呈正相关,而肝细胞标记基因则呈负相关。(见图4)
研究发现,T细胞、NK细胞、成熟B细胞和巨噬细胞在肝炎阶段的表达显著上调,血清ALT水平与这些细胞的标记基因呈正相关,表明它们在肝损伤中起重要作用。相反,肝细胞标记基因与ALT水平呈负相关。
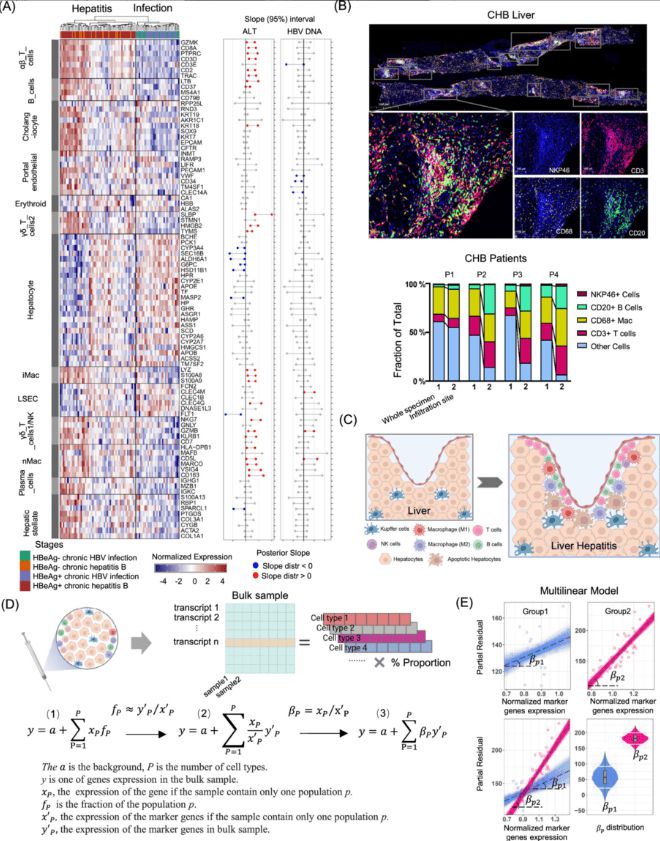
(该图展示了在肝炎阶段,T细胞、NK细胞、成熟B细胞和巨噬细胞的标记基因表达显著上调,血清ALT水平与这些细胞标记基因呈正相关龙8long8,而肝细胞标记基因则呈负相关,表明这些免疫细胞在肝损伤中的重要作用。)
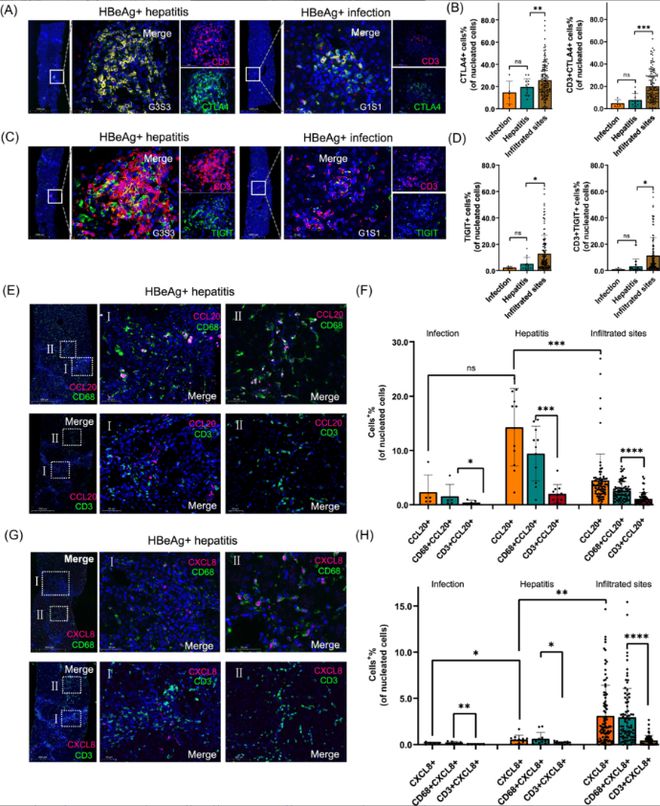
研究通过PSEA模型分析,发现趋化因子如CCL20和CXCL8主要由巨噬细胞和T细胞表达,这些基因与ALT水平呈显著正相关,表明其在肝损伤中的重要作用。(见图5、6)
此外,免疫耗竭标记基因如PDCD1(编码PD-1)和HAVCR2(编码TIM-3)在肝炎阶段上调,提示免疫细胞在慢性肝炎中的功能耗竭。
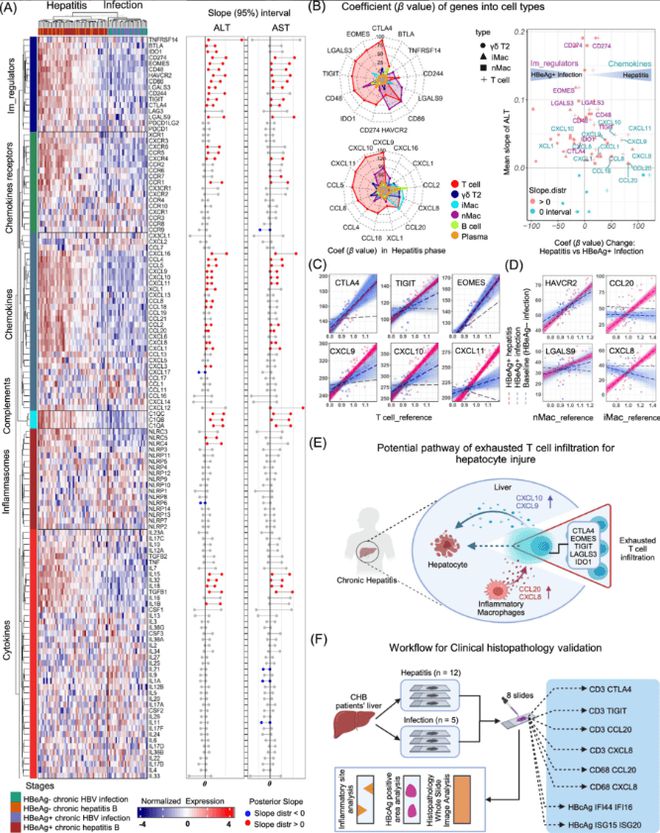
(该图展示了通过PSEA模型分析的结果,龙8登录趋化因子如CCL20和CXCL8主要由巨噬细胞和T细胞表达,这些基因与ALT水平呈显著正相关。此外,免疫耗竭标记基因如PDCD1(编码PD-1)和HAVCR2(编码TIM-3)在肝炎阶段上调,提示免疫细胞在慢性肝炎中的功能耗竭。)
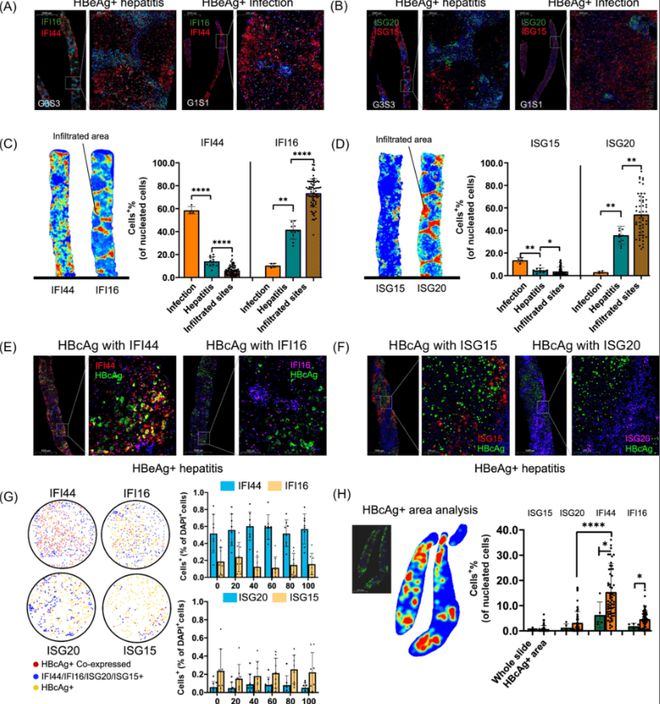
研究分析显示,79个ISGs在肝炎阶段上调,其中包括STAT1、STAT2、ISG15、ISG20等。通过PSEA模型,发现T细胞和巨噬细胞主要贡献了这些基因的表达,而B细胞和肝细胞的ISGs表达则与ALT水平无显著相关。(见图7、8)
研究发现,79个ISGs在肝炎阶段显著上调,包括STAT1、STAT2、ISG15和ISG20。这些基因主要由T细胞和巨噬细胞表达,表明干扰素信号在肝炎中的重要作用。相较之下,B细胞和肝细胞的ISGs表达与ALT水平无显著相关。
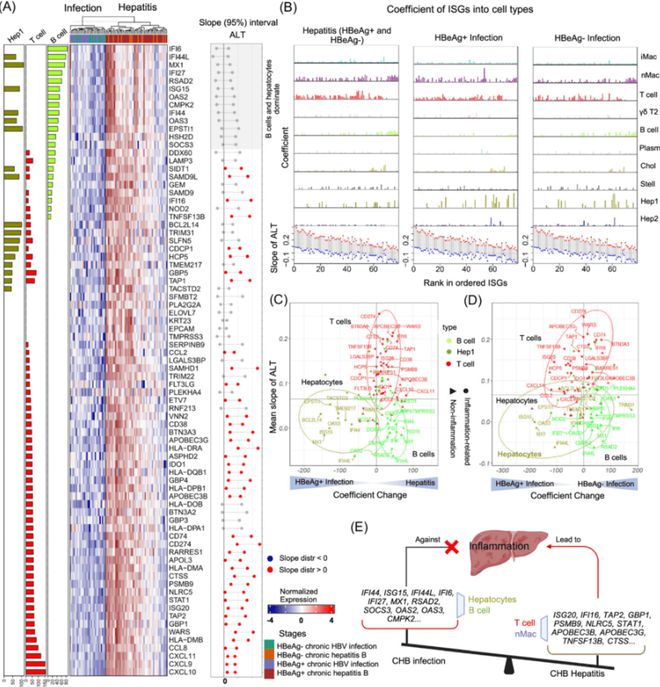
(该图展示了79个干扰素刺激基因(ISGs)在肝炎阶段显著上调的情况,包括STAT1、STAT2、ISG15和ISG20。通过PSEA模型分析,T细胞和巨噬细胞主要贡献了这些基因的表达,显示出干扰素信号在肝炎中的重要作用。)
1、多组学整合分析:通过整合肝脏的整体转录组数据、单细胞测序数据和临床数据,从多组学角度全面分析CHB肝内炎症形成的机制。
2、细胞类型特异性表达分析:通过PSEA模型,将整体基因表达分解为特定细胞类型,揭示了不同细胞类型在肝损伤中的特定作用。
3、趋化因子与ISGs的关键作用:发现趋化因子如CCL20和CXCL8在肝损伤中的重要作用,以及特定ISGs在肝炎阶段的上调,揭示了其在肝损伤中的潜在机制。这些基因的显著上调和表达模式的变化提供了关于CHB肝内炎症形成的新见解,可能成为未来治疗的潜在靶点。
本研究通过多组学整合分析,揭示了慢性乙型肝炎肝内炎症形成的关键因素。研究表明,特定细胞类型在肝损伤中的作用,以及趋化因子和干扰素刺激基因在肝炎中的上调,提供了关于肝炎机制的深刻见解。通过了解这些基因和细胞类型在CHB中的具体作用,未来可以开发更有效的诊断工具和治疗策略,以改善CHB患者的预后。